Как составлять структурные формулы кислот. Структурные формулы основных представителей карбоновых кислот. Химические формулы кислот
Формулы кислот
Определение и формулы кислот
Кислоты – электролиты, при диссоциации которых из положительных ионов образуются только ионы H + :
Все кислоты классифицируют на неорганические и органические (карбоновые), которые также имеют свои собственные (внутренние) классификации.
При нормальных условияхзначительное количество неорганических кислот существуют в жидком состоянии, некоторые – в твёрдом состоянии (H3PO4, H3BO3).
Органические кислоты с числом атомов углерода до 3 представляют собой легкоподвижные бесцветные жидкости с характерным резким запахом; кислоты с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом, а кислоты с большим количеством атомов углерода— твёрдые вещества, нерастворимые в воде.
Химические формулы кислот
Химические формулы кислот рассмотрим на примере нескольких представителей (как неорганических, так и органических): хлороводородной кислоте –HCl, серной кислоте – H2SO4, фосфорной кислоте — H3PO4, уксусной кислоте – CH3COOH и бензойной кислоте – C6H5COOH. Химическая формула показывает качественный и количественный состав молекулы (сколько и каких атомов входит в конкретное соединение) По химической формуле можно вычислить молекулярную массу кислот (Ar(H) = 1 а.е.м., Ar(Cl) = 35,5 а.е.м., Ar(P) = 31 а.е.м., Ar(O) = 16 а.е.м., Ar(S) = 32 а.е.м., Ar(C) = 12 а.е.м.):
Mr(HCl) = Ar(H) + Ar(Cl);
Mr(HCl) = 1 + 35,5 = 36,5.
Mr(H2SO4) = 2×1 + 32 + 4×16 = 2 + 32 + 64 = 98.
Mr(H3PO4) = 3×1 + 31 + 4×16 = 3 + 31 + 64 = 98.
Mr(CH3COOH) = 3×Ar(С) + 4×Ar(H) + 2×Ar(O);
Mr(CH3COOH) = 3×12 + 4×1 + 2×16 = 36 + 4 + 32 = 72.
Mr(C6H5COOH) = 7×12 + 6×1 + 2×16 = 84 + 6 + 32 = 122.
Структурные (графические) формулы кислот
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Укажем структурные формулы каждого из вышеуказанных соединений:
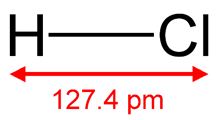
Рис. 1. Структурная формула хлороводородной кислоты.
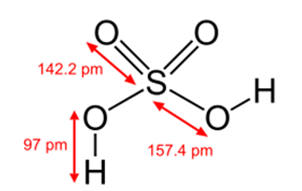
Рис. 2. Структурная формула серной кислоты.
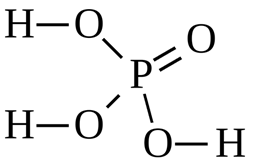
Рис. 3. Структурная формула фосфорной кислоты.
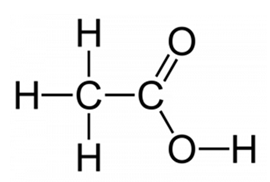
Рис. 4. Структурная формула уксусной кислоты.
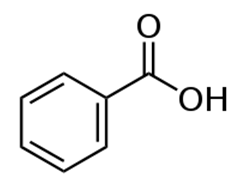
Рис. 5. Структурная формула бензойной кислоты.
Ионные формулы
Все неорганические кислоты являются электролитами, т.е. способны диссоциировать в водном растворе на ионы:
Примеры решения задач
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [8,8 / 44]×12 = 2,4 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 2,4/12 :0,4/1 :3,2/16;
x:y:z= 0,2 : 0,4 : 0,2 = 1: 2 : 1.
Значит простейшая формула соединения CH2Oи молярную массу 30 г/моль [M(CH2O) = Ar(C) + 2×Ar(H) + Ar(O) = 12 + 2×1 + 16 = 12 + 2 + 16 = 30 / моль].
Чтобы найти истинную формулу органического соединения найдем отношение истинной и полученной молярных масс:
Msubstance / M(CH2O) = 180 / 30 = 6.
Значит индексы атомов углерода, водорода и кислорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H12O6. Это глюкоза или фруктоза.
Карбоновые кислоты. Строение, физические свойства, номенклатура
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

Урок поможет вам получить представление о теме «Карбоновые кислоты. Строение, физические свойства, номенклатура» (школьная программа по химии 10 класса). В ходе занятия вы узнаете определение карбоновых (органических) кислот и их свойств, которые обусловлены наличием в их молекуле карбоксиловой группы.
Тема: Карбонильные соединения. Карбоновые кислоты
Урок: Карбоновые кислоты. Строение, физические свойства, номенклатура
1. Классификация карбоновых кислот
Карбоновые кислоты часто называют просто органическими кислотами за их кислотные свойства. Есть еще органические вещества, проявляющие кислотные свойства, например, фенолы. Но именно у карбоновых кислот – эти свойства выражены наиболее сильно. Свойства карбоновых кислот обусловлены наличием в них карбоксильной группы или карбоксила. Карбоксильная группа образована сочетанием двух групп:

Карбоксильная группа – СООН – функциональная группа карбоновых кислот.
2. Номенклатура
Название кислот образуется так, что к названию предельного углеводорода прибавляется
-овая кислота.
Формула алкана
Название алкана
Формула кислоты
Название кислоты.
метан
НСООН
метановая кислота (муравьиная)
этан
СН3СООН
этановая кислота (уксусная)
пропан
С2Н5СООН
пропановая кислота (пропионовая)

5,5-диметилгексановая кислота

2-этилбутановая кислота

3-карбокси-3-гидроксипентандиовая-1,5 кислота (лимонная)
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
Непредельные кислоты:
Ароматические кислоты:
Двухосновные кислоты:
3. Физические свойства
Водородные связи (прочнее, чем у молекул спиртов!)
1. температуры кипения и плавления карбоновых кислот намного выше, не только чем у соответствующих углеводородов, но и чем у спиртов;
2. хорошая растворимость в воде (с увеличением углеводородного радикала уменьшается).
Водородные связи в карбоновых кислотах настолько сильны, что эти вещества образуют димеры:

Почему водородные связи между молекулами карбоновых кислот прочнее, чем между молекулами спиртов?
Потому что в карбоксильной группе выше положительный заряд на атоме водорода в гидроксиле: электроотрицательный атом кислорода карбонильной группы стягивает электронную плотность с гидроксильной группы.
Температуры плавления и кипения
Почему температура кипения разветвленного изомера бутановой кислоты ниже, чем изомера нормального строения?
Разветвленный углеводородный радикал подает на карбоксильную группу большую электронную плотность, чем неразветвленный, и полярность связи О- Н уменьшается по сравнению с изомером нормального строения.
Почему температуры плавления изменяются зигзагообразно?

Растворимость

На переход из твердого состояния в жидкое (разрушение кристалла) влияет не только сила межмолекулярного взаимодействия, но еще и способ упаковки молекул в кристаллической решетке. От числа (четности) атомов углерода в молекуле зависит, под каким углом друг к другу будут расположены карбоксильные группы в кристалле. В зависимости от этого между молекулами образуются две или одна водородная связь, а это очень сильно влияет на прочность кристалла.
Кислоты, содержащие более 10 атомов углерода, можно считать нерастворимыми.
Подведение итога урока
При помощи данного урока вы смогли самостоятельно изучить тему «Карбоновые кислоты. Строение, физические свойства, номенклатура» (школьная программа по химии 10 класса). В ходе занятия вы узнали определение карбоновых (органических) кислот и их свойств, которые обусловлены наличием в их молекуле карбоксильной группы.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Органическая химия (Источник).
Домашнее задание
1. №№ 1, 3 (с. 113) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Какие две кислоты имеют общую молекулярную формулу С4Н8О2. Назовите их.
3. Какая из кислот монохлоруксусная или уксусная должна быть сильнее? Почему?
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Карбоновые кислоты — номенклатура, получение, химические свойства

Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
связанных с углеводородным радикалом.
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота: HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.

Изомерия карбоновых кислот
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Строение карбоксильной группы:

Электронная плотность π-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
В водном растворе карбоновые кислоты диссоциируют на ионы.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Способы получения карбоновых кислот

Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на силу карбоновых кислот
- Донорные группы увеличивают прочность связи кислород-водород или дестабилизируют карбоксилат анион, подавая ещё больше электронной плотности, это приводит к уменьшению силы кислот.
- Акцепторные группы уменьшают электронную плотность связи кислород-водород или стабилизируют карбоксилат анион, это приводит к увеличению силы кислот (значение рКа уменьшается).
Источники:
http://ru.solverbook.com/spravochnik/formuly-po-ximii/formuly-kislot/
http://interneturok.ru/lesson/chemistry/10-klass/karbonilnye-soedineniya-karbonovye-kisloty/karbonovye-kisloty-stroenie-fizicheskie-svoystva-nomenklatura?konspekt
http://himege.ru/karbonovye-kisloty-nomenklatura-poluchenie-ximicheskie-svojstva/



